Các thay đổi không cần tiến hành khảo nghiệm
- Thay đổi quyền sở hữu số đăng ký lưu hành;
- Đổi tên thương mại của chế phẩm;
- Thay đổi tên, địa chỉ liên lạc của cơ sở đăng ký, tên cơ sở sản xuất, địa chỉ nơi sản xuất;
Thành phần hồ sơ
1. Đối với trường hợp thay đổi quyền sở hữu số đăng ký lưu hành:
- Văn bản đề nghị đăng ký lưu hành bổ sung theo mẫu quy định.
- Giấy ủy quyền thực hiện việc đăng ký lưu hành (trường hợp được Ủy quyền đăng ký)
- Văn bản chuyển quyền sở hữu số đăng ký lưu hành của chủ sở hữu số đăng ký lưu hành;
- Văn bản tiếp nhận quyền sở hữu số đăng ký lưu hành và cam kết sau khi tiếp nhận số đăng ký lưu hành sẽ tiếp tục đảm bảo việc kinh doanh chế phẩm đúng với hồ sơ đã được Bộ Y tế phê duyệt;
- Giấy tờ về tư cách pháp nhân của cơ sở tiếp nhận số đăng ký lưu hành;
- Mẫu nhãn mới của chế phẩm. Mẫu nhãn, nội dung nhãn phụ của chế phẩm phải đáp ứng các yêu cầu theo quy định;
2. Đối với trường hợp đổi tên thương mại của chế phẩm:
- Văn bản đề nghị đăng ký lưu hành bổ sung theo mẫu quy định.
- Giấy ủy quyền thực hiện việc đăng ký lưu hành chế phẩm với tên thương mại mới, trừ trường hợp quy định tại Điểm a Khoản 1 Điều 20 Nghị định này;
- Giấy chứng nhận lưu hành tự do của chế phẩm với tên thương mại mới (đối với chế phẩm nhập khẩu);
- Mẫu nhãn mới của chế phẩm. Mẫu nhãn, nội dung nhãn phụ của chế phẩm phải đáp ứng các yêu cầu theo quy định;
3. Trường hợp thay đổi tên, địa chỉ liên lạc của cơ sở đăng ký, tên cơ sở sản xuất, địa chỉ nơi sản xuất:
- Văn bản đề nghị đăng ký lưu hành bổ sung theo mẫu quy định.
- Giấy tờ về tư cách pháp nhân của cơ sở đăng ký, cơ sở sản xuất ghi nội dung thay đổi (đối với cơ sở tại Việt Nam), văn bản thông báo thay đổi tên, địa chỉ (đối với cơ sở tại nước ngoài);
- Mẫu nhãn mới của chế phẩm. Mẫu nhãn, nội dung nhãn phụ của chế phẩm phải đáp ứng các yêu cầu theo quy định.
Yêu cầu về hình thức hồ sơ:
- Hồ sơ phải được làm thành 01 bộ bản giấy kèm theo bản điện tử định dạng PDF.
- Các tài liệu trong hồ sơ được in rõ ràng, sắp xếp theo trình tự, giữa các phần có phân cách, có trang bìa và danh mục tài liệu.
- Các tài liệu bằng tiếng Anh phải dịch ra tiếng Việt và kèm theo tài liệu gốc. Tài liệu bằng tiếng nước ngoài không phải là tiếng Anh phải được dịch ra tiếng Việt, bản dịch tiếng Việt phải được công chứng theo quy định của pháp luật.
- Các giấy tờ khác trong bộ hồ sơ đăng ký lưu hành phải được cơ sở đăng ký đóng dấu giáp lai hoặc vào từng trang tài liệu.
Quy trình thẩm định

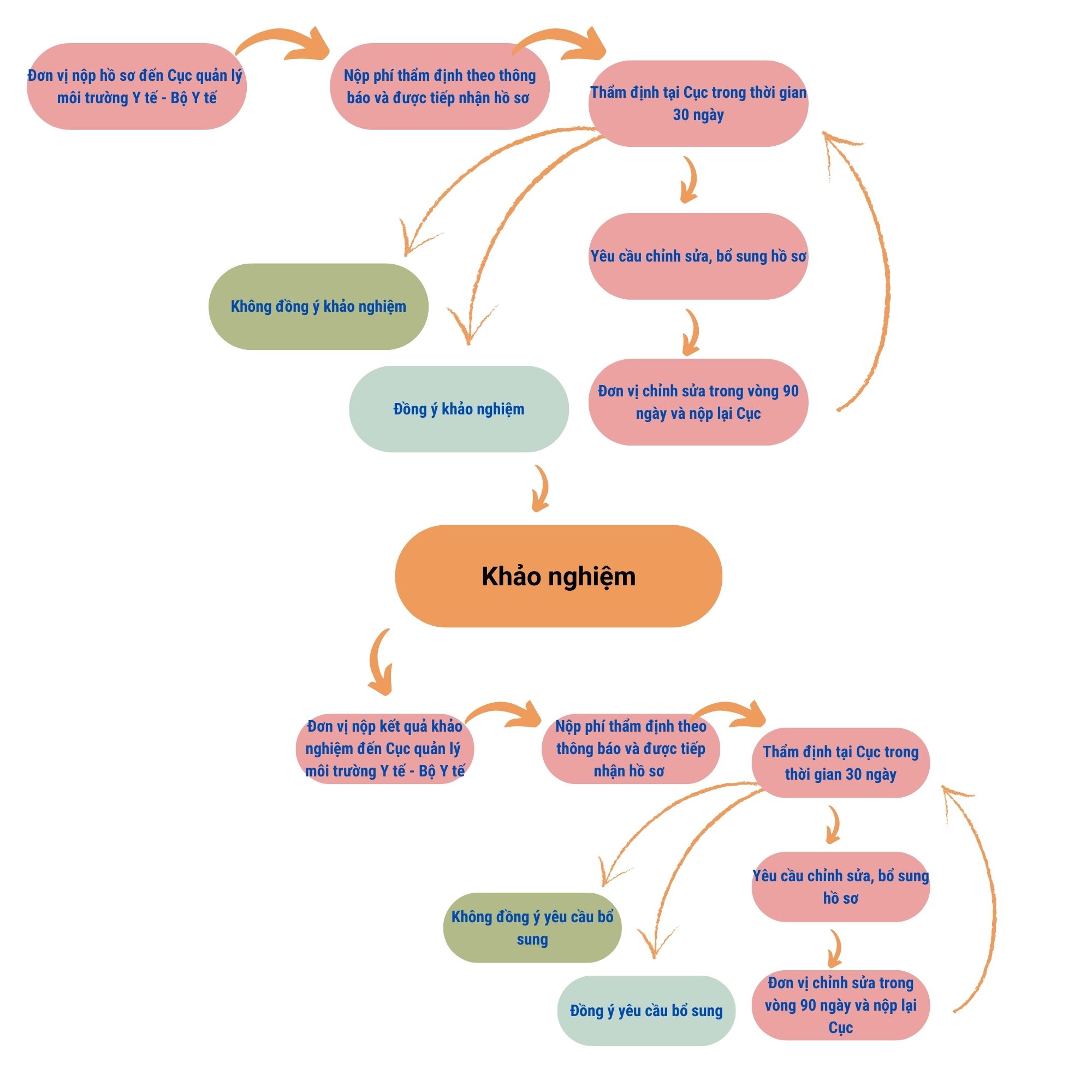
- Cơ sở đăng ký nộp hồ sơ trực tiếp hoặc gửi hồ sơ qua bưu điện đến Bộ Y tế.
- Sau khi nhận được hồ sơ, phí thẩm định hồ sơ đăng ký lưu hành bổ sung, Bộ Y
- Trong thời hạn 30 ngày, kể từ ngày ghi trên Phiếu tiếp nhận hồ sơ, Bộ Y tế có trách nhiệm thông báo bằng văn bản cho cơ sở đăng ký lưu hành bổ sung về việc: Bổ sung, sửa đổi hồ sơ hoặc đồng ý hoặc không đồng ý với nội dung đăng ký lưu hành bổ sung và nêu rõ lý do.
- Trường hợp Bộ Y tế có văn bản yêu cầu bổ sung, sửa đổi hồ sơ, trong thời hạn 90 ngày, kể từ ngày ghi trên văn bản, cơ sở đăng ký bổ sung phải hoàn chỉnh hồ sơ, giải trình bằng văn bản và gửi đến Bộ Y tế. Ngày tiếp nhận hồ sơ bổ sung, sửa đổi được ghi trên Phiếu tiếp nhận hồ sơ. Quá thời hạn trên, hồ sơ đăng ký lưu hành bổ sung sẽ bị hủy bỏ.
- Trường hợp không còn yêu cầu bổ sung, sửa đổi, Bộ Y tế phải thực hiện việc bổ sung Giấy chứng nhận đăng ký lưu hành.
Các thay đổi cần tiến hàng khảo nghiệm lại
- Thay đổi địa điểm cơ sở sản xuất, thay đổi cơ sở sản xuất;
- Thay đổi tác dụng, chỉ tiêu chất lượng, phương pháp sử dụng chế phẩm.
Thành phần hồ sơ:
1. Đối với trường hợp chuyển nơi sản xuất, thay đổi cơ sở sản xuất:
- Văn bản đề nghị đăng ký lưu hành bổ sung theo mẫu quy định.
- Giấy tờ về tư cách pháp nhân của cơ sở sản xuất ghi địa điểm mới (đối với cơ sở tại Việt Nam), văn bản thông báo thay đổi địa điểm, cơ sở sản xuất (đối với cơ sở tại nước ngoài);
- Giấy ủy quyền thực hiện việc đăng ký lưu hành (trường hợp được Ủy quyền đăng ký)
- Giấy chứng nhận lưu hành tự do, trừ trường hợp chế phẩm đã được cấp số đăng ký lưu hành để sản xuất tại Việt Nam và đăng ký bổ sung cơ sở sản xuất tại nước ngoài;
- Mẫu nhãn mới của chế phẩm. Mẫu nhãn, nội dung nhãn phụ của chế phẩm phải đáp ứng các yêu cầu theo quy định;
- Phiếu trả lời kết quả khảo nghiệm chế phẩm sản xuất tại cơ sở mới;
2. Đối với trường hợp thay đổi tác dụng, chỉ tiêu chất lượng, phương pháp sử dụng:
- Văn bản đề nghị đăng ký lưu hành bổ sung theo mẫu quy định.
- Tài liệu nghiên cứu độ ổn định (đối với trường hợp thay đổi hạn sử dụng của chế phẩm);
- Kết quả kiểm nghiệm thành phần và hàm lượng hoạt chất (đối với trường hợp thay đổi thành phần và hàm lượng hoạt chất);
- Mẫu nhãn mới của chế phẩm. Mẫu nhãn, nội dung nhãn phụ của chế phẩm phải đáp ứng các yêu cầu theo quy định;
Yêu cầu về hình thức hồ sơ:
- Hồ sơ phải được làm thành 01 bộ bản giấy kèm theo bản điện tử định dạng PDF.
- Các tài liệu trong hồ sơ được in rõ ràng, sắp xếp theo trình tự, giữa các phần có phân cách, có trang bìa và danh mục tài liệu.
- Các tài liệu bằng tiếng Anh phải dịch ra tiếng Việt và kèm theo tài liệu gốc. Tài liệu bằng tiếng nước ngoài không phải là tiếng Anh phải được dịch ra tiếng Việt, bản dịch tiếng Việt phải được công chứng theo quy định của pháp luật.
- Các giấy tờ khác trong bộ hồ sơ đăng ký lưu hành phải được cơ sở đăng ký đóng dấu giáp lai hoặc vào từng trang tài liệu.
Quy trình thẩm định
- Cơ sở đăng ký nộp hồ sơ trực tiếp hoặc gửi hồ sơ qua bưu điện đến Bộ Y tế.
- Sau khi nhận được hồ sơ, phí thẩm định hồ sơ đăng ký lưu hành bổ sung, Bộ Y
- Trong thời hạn 30 ngày, kể từ ngày ghi trên Phiếu tiếp nhận hồ sơ, Bộ Y tế có trách nhiệm thông báo bằng văn bản cho cơ sở đăng ký lưu hành bổ sung về việc bổ sung, sửa đổi hồ sơ hoặc cho phép khảo nghiệm hoặc không cho phép khảo nghiệm và nêu rõ lý do.
- Trường hợp Bộ Y tế có văn bản cho phép khảo nghiệm, trong thời hạn tối đa 12 tháng, kể từ ngày ghi trên công văn cho phép khảo nghiệm, cơ sở đăng ký lưu hành bổ sung phải nộp kết quả khảo nghiệm để bổ sung vào hồ sơ. Quá thời hạn trên, hồ sơ đăng ký lưu hành bổ sung sẽ bị hủy bỏ.
- Trường hợp Bộ Y tế có văn bản yêu cầu bổ sung, sửa đổi hồ sơ, trong thời hạn 90 ngày, kể từ ngày ghi trên văn bản, cơ sở đăng ký bổ sung phải hoàn chỉnh hồ sơ, giải trình bằng văn bản và gửi đến Bộ Y tế. Ngày tiếp nhận hồ sơ bổ sung, sửa đổi được ghi trên Phiếu tiếp nhận hồ sơ. Quá thời hạn trên, hồ sơ đăng ký lưu hành bổ sung sẽ bị hủy bỏ.
- Trường hợp không còn yêu cầu bổ sung, sửa đổi, Bộ Y tế phải thực hiện việc bổ sung Giấy chứng nhận đăng ký lưu hành.
Các thay đổi liên quan đến mẫu nhãn và quy cách đóng gói
Khi có thay đổi nội dung, hình thức nhãn chế phẩm ngoài các nội dung phải đăng ký bổ sung, chủ sở hữu số đăng ký lưu hành phải có văn bản thông báo nội dung thay đổi và gửi kèm mẫu nhãn mới (gồm mẫu nhãn của tất cả các quy cách đóng gói theo kích thước thực, trường hợp nhiều quy cách đóng gói có nhãn thiết kế giống nhau, chủ sở hữu số đăng ký lưu hành nộp nhãn của quy cách đóng gói nhỏ nhất) đến Bộ Y tế để bổ sung vào hồ sơ chậm nhất là 15 ngày trước khi lưu hành nhãn mới.
Trong thời hạn 05 ngày làm việc, kể từ ngày nhận được văn bản thông báo thay đổi nội dung nhãn (thời điểm tiếp nhận văn bản thông báo được tính theo ngày ghi trên dấu tiếp nhận công văn đến của Bộ Y tế), nếu Bộ Y tế không có văn bản yêu cầu sửa đổi bổ sung thì chủ sở hữu số đăng ký lưu hành được quyền lưu hành nhãn mới;
